Neuroendocrinology, n. 1/2017
L'azione degli estrogeni sulla modulazione dei circuiti ipotalamici che controllano ansietà e metabolismo è mediata dal recettore di membrana GPER-1
Grassi D.a-f, Lagunas N.a, b, Pinos H.a, Panzica G.C.d, e, Garcia-Segura L.M.b, Collado P.a
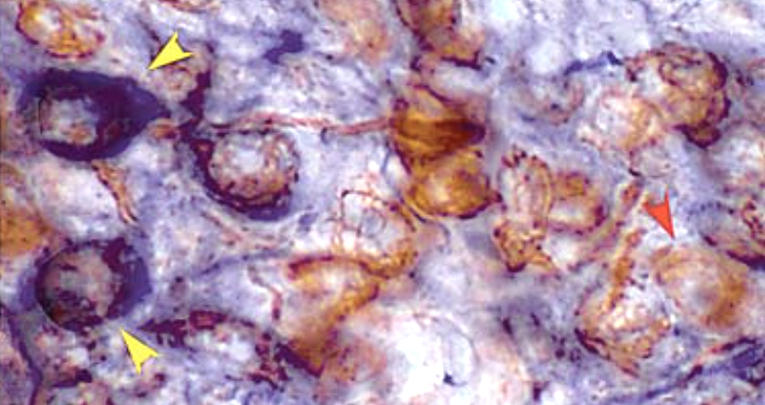
L’ossido di azoto (NO) è un neurotrasmettitore gassoso che svolge un gran numero di funzioni all’interno del sistema nervoso centrale e periferico. In precedenti lavori i nostri tre gruppi di ricerca (UNED, Cajal e Neuroendocrinologia del NICO) hanno dimostrato che l’attività dell’enzima che produce NO (neural nitric oxide synthase, nNOS) è modulata dagli estrogeni (Grassi et al., 2013) tramite i recettori intracitoplasmatici ERalfa e ERbeta.
Dal momento che i neuroni del nucleo sopraottico (SON) e paraventricolare (PVN) esprimono anche il recettore di membrana per gli estrogeni (GPER-1), in questo studio sperimentale abbiamo voluto testare se anch’esso sia implicato nel controllo della produzione di NO.
I nostri risultati dimostrano che bloccando farmacologicamente GPER1 con l’agonista G1 si ha l’inibizione sia dell’attività enzimatica della nNOS, sia dei mediatori intracellulari della sua azione come la fosforilazione di ERK 1/2, effetto che viene invece eliminato dal trattamento simultaneo di G1 e dell’antagonista G15.
Nel ratto, GPER-1 e ERbeta sono espressi sia nel SON che nel PVN, mentre ERalfa non è espresso, tuttavia neuroni che esprimono ERalfa proiettano sia al PVN, sia al SON. In conclusione, la risposta finale del sistema di neuroni produttori di NO agli estrogeni dipende probabilmente dal bilanciamento tra l’azione locale del GPER-1 e del ERbeta, mediata dalla fosforilazione-defosforilazione di ERK 1/2, e un'azione indiretta tramite afferenze da neuroni regolati da ERalfa.
a Department of Psychobiology, Universidad Nacional de Educacion a Distancia (UNED)
b I nstituto Cajal, CSIC, Madrid
c Department of Basic Biomedical Science, Universidad Europea de Madrid, Villaviciosa de Odon, Spain;
d Department of Neuroscience, University of Turin, Turin
e Neuroscience Institute Cavalieri Ottolenghi (NICO), Orbassano, Italy
f Institute of Anatomy and Cell Biology, Department of Molecular Embryology, Albert-Ludwigs-Universität Freiburg, Freiburg, Germany
Agenda
Area Ricercatori
Guarda il video
GiovedìScienza racconta la ricerca al NICO
Vivere per sempre.
Una popolazione sempre più longeva, i suoi problemi e le risposte della ricerca
Hai perso la diretta? Guarda ora il video di GiovedìScienza al NICO: una puntata in diretta dai nostri laboratori dedicata alla ricerca sull'invecchiamento.