Developmental Cell, 9 ottobre 2017
Un nuovo interruttore per mettere in moto la plasticità cerebrale
Anissa Kempf,1,6,9 Enrica Boda,2 Jessica C.F. Kwok,3,8 Rafael Fritz,4 Valentina Grande,2 Andrea M. Kaelin,1 Zorica Ristic,1 Andre Schmandke,1 Antonio Schmandke,1 Bjoern Tews,5 James W. Fawcett,3 Olivier Pertz,4,7 Annalisa Buffo,2 and Martin E. Schwab 1
In questo studio – pubblicato sulla prestigiosa rivista Developmental Cell - Annalisa Buffo ha contribuito con il suo gruppo di ricercatrici a identificare un nuovo recettore della proteina NoGo-A, un noto regolatore di tutte le forme di plasticità nervosa nel sistema nervoso centrale che studiamo ormai da vent'anni.
NoGo-A, originariamente scoperta come semplice costituente della mielina, opera nel cervello sano bilanciando la formazione di nuovi contatti, la crescita di nuovi prolungamenti nervosi e la produzione di nuovi neuroni dalle cellule staminali, in modo da favorire l’adattamento del cervello a nuove esperienze e la formazione di nuove memorie.
leggi a proposito:
Se il cervello dice NO GO - dicembre 2012
Un nuovo meccanismo che controlla le cellule staminali. La scoperta dei ricercatori del NICO di Orbassano (TO) sul Journal of Neuroscience.
La stessa proteina, però, è un inibitore potentissimo della riparazione dei circuiti interrotti dopo un danno. Essa agisce attraverso una famiglia di recettori chiamati NgR. Tuttavia, da molto tempo risultava chiaro che la ‘coda’ di questa molecola esercitasse delle azioni specifiche non attribuibili ai NgR. La caccia a questi altri recettori sconosciuti è durata molti anni.
Il nostro lavoro, coordinato dall’équipe di Martin Schwab (Brain Research Institute, Università di Zurigo), ha contribuito a identificare negli zuccheri di membrana Eparan Solfato Proteoglicani recettori specifici per la ‘coda’ di NoGo-A.
Questo lavoro offre nuovi spunti per la comprensione delle basi molecolari della plasticità nervosa e dei meccanismi che possono stimolare la riparazione del cervello danneggiato.
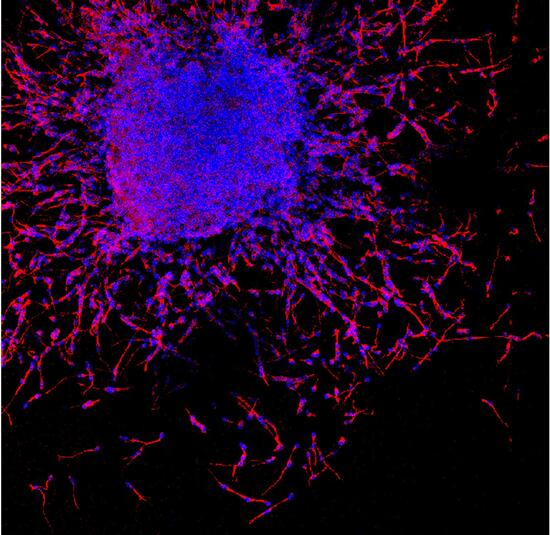
In questa immagine giovani neuroni (in rosso) prodotti dalle cellule staminali neurali si allontanano migrando dalla cellula madre che li ha prodotti.
In una prima fase le cellule si spostano scivolando le une sulle altre grazie a segnali di repulsione determinati dall’interazione tra NoGo-A e gli Eparan Solfato Proteoglicani.
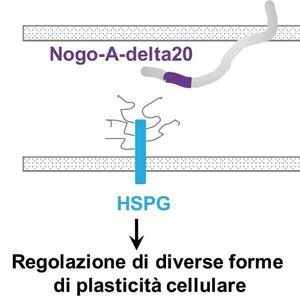
NoGo-A è una proteina di membrana.
La sua ‘coda’ (segmento delta20, in viola) interagisce con molecole di eparan solfato proteoglicani (azzurro) della membrana di cellule adiacenti mediando diversi effetti sulla plasticità cerebrale.
1 Brain Research Institute, University of Zurich and Department of Health Sciences and Technology, Swiss Federal Institute of Technology (ETH) Zurich, 8057 Zurich, Switzerland
2 Department of Neuroscience, Neuroscience Institute Cavalieri Ottolenghi (NICO), Università degli Studi di Torino, Orbassano, Turin 10043, Italy
3 John van Geest Centre for Brain Repair, Department of Clinical Neurosciences, University of Cambridge, Robinson Way, Cambridge CB2 0PY, UK
4 Institute for Biochemistry and Genetics, Department of Biomedicine, University of Basel, 4058 Basel, Switzerland
5 Schaller Research Group at the University of Heidelberg and the German Cancer Research Center (DKFZ), Molecular Mechanisms of Tumor Invasion, 69120 Heidelberg, Germany
6 Present address: University of Oxford, Centre for Neural Circuits and Behaviour, Oxford OX1 3SR, UK
7 Present address: Institute of Cell Biology, University of Bern, Bern 3012, Switzerland
8 Present address: School of Biomedical Sciences, Faculty of Biological Sciences, University of Leeds, Leeds LS2 9JT, UK
Agenda
Area Ricercatori
Guarda il video
GiovedìScienza racconta la ricerca al NICO
Vivere per sempre.
Una popolazione sempre più longeva, i suoi problemi e le risposte della ricerca
Hai perso la diretta? Guarda ora il video di GiovedìScienza al NICO: una puntata in diretta dai nostri laboratori dedicata alla ricerca sull'invecchiamento.