Autophagy, agosto 2014
Chiarito meccanismo che può rallentare l'Alzheimer
I nostri ricercatori hanno chiarito uno dei meccanismi che impedendo alle cellule del cervello di 'ripulirsi' favorisce lo sviluppo dell'Alzheimer, la più comune patologia legata all'invecchiamento.
L'accumulo nel tessuto cerebrale di peptidi di β amiloide (Aβ), i principali componenti delle placche senili, è una delle cause principali della malattia.
Elena Tamagno, Michela Guglielmotto e Antonio Piras - del gruppo di ricerca guidato dal nostro direttore Alessandro Vercelli - hanno individuato la relazione che lega la presenza di questa molecola ai principali meccanismi di morte e ricambio cellulare, entrambi responsabili della neurodegenerazione e dello sviluppo della malattia.
L'accumulo di depositi o detriti cellulari impedisce, anche negli organismi sani, il buon funzionamento delle cellule. Nella malattia di Alzheimer il meccanismo di degradazione che normalmente garantisce il ricambio cellulare è alterato, ma ad oggi non era chiaro il meccanismo molecolare che impedisce alle cellule malate di smaltire i 'rifiuti', che blocca cioè il normale processo di autofagia provocando uno stato di sofferenza.
Lo studio, pubblicato sulla prestigiosa rivista scientifica Autophagy, è nato nei nostri laboratori, ma è frutto di una collaborazione a livello nazionale e internazionale. Hanno infatti partecipato - oltre al Dipartimento di Scienze Biologiche e Cliniche dell'Università di Torino - ricercatori dell'Università di Catania, Genova, Losanna e della Columbia University di New York. [ leggi il comunicato stampa - vai alla rassegna stampa ]
Nella foto, da sinistra: Debora Monteleone, Elena Tamagno e Michela Guglielmotto.
Autophagy, 12 August 2014
Aβ1-42 monomers or oligomers have different effects on autophagy and apoptosis
Michela Guglielmotto,1,2 Debora Monteleone,3,2 Antonio Piras,1,2 Valeria Valsecchi,1,2 Marta Tropiano,1,2 Stefania Ariano,3,2 Michele Fornaro,4 Alessandro Vercelli,1,2 Julien Puyal,5,6 Ottavio Arancio,7 Massimo Tabaton,8 and Elena Tamagno1,2,*
The role of autophagy and its relationship with apoptosis in Alzheimer disease (AD) pathogenesis is poorly understood. Disruption of autophagy leads to buildup of incompletely digested substrates, amyloid-β (Aβ) peptide accumulation in vacuoles and cell death. Aβ, in turn, has been found to affect autophagy. Thus, Aβ might be part of a loop in which it is both the substrate of altered autophagy and its cause. Given the relevance of different soluble forms of Aβ1-42 in AD, we have investigated whether monomers and oligomers of the peptide have a differential role in causing altered autophagy and cell death.
Using differentiated SK-N-BE neuroblastoma cells, we found that monomers hamper the formation of the autophagic BCL 2-BECN 1/beclin 1 complex and activate the MAPK8/JNK1-MAPK9/JNK2 pathway phosphorylating BCL 2. Monomers also inhibit apoptosis and allow autophagy with intracellular accumulation of autophagosomes and elevation of levels of BECN 1 and LC 3-II , resulting in an inhibition of substrate degradation due to an inhibitory action on lysosomal activity. Oligomers, in turn, favor the formation of the BCL 2-BECN 1 complex favoring apoptosis. In addition, they cause a less profound increase in BECN 1 and LC 3-II levels than monomers without affecting the autophagic flux. Thus, data presented in this work show a link for autophagy and apoptosis with monomers and oligomers, respectively. These studies are likely to help the design of novel disease modifying therapies. [ read more ]
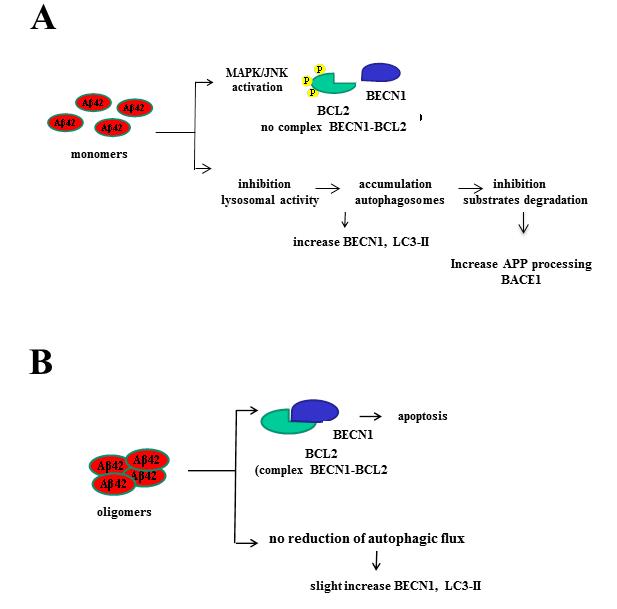
Proposed effects onto autophagy and apoptosis elicited by Aß1-42 monomers and oligomers.
(A) Monomers impede formation of the BCL2-BECN1 complex by activation of the MAPK/JNK pathway that phosphorylates BCL2. Monomers also cause early endosome accumulation due to an inhibitory action on lysosomal activity, resulting in intracellular accumulation of autophagosomes with elevation of levels of BECN1 and LC3-II, and inhibition of substrate degradation.
(B) Oligomers favor the formation of the BCL2-BECN1 complex leading to apoptosis. They also cause a less profound increase in BECN1 and LC3-II levels and do not affect the autophagic flux.
1Department of Neuroscience; University of Torino; Torino, Italy; 2Neuroscience Institute of Cavalieri Ottolenghi Foundation (NICO ); University of Torino; Torino, Italy; 3Department of Clinical and Biological Sciences; University of Torino; Torino, Italy; 4Scienza della Formazione; University of Catania; Italy; 5Department of Fundamental Neurosciences; Faculty of Biology and Medicine; University of Lausanne; Lausanne, Switzerland; 6Clinic of Neonatology; Department of Pediatrics and Pediatric Surgery; Lausanne University Hospital and University of Lausanne; Lausanne, Switzerland; 7Department of Pathology and Cell Biology; Taub Institute for Research on Alzheimer's Disease and the Aging Brain; Columbia University; New York, NY USA ; 8Department of Internal Medicine; Unit of Geriatric Medicine; University of Genoa; Genoa, Italy
Agenda
Area Ricercatori
Guarda il video
GiovedìScienza racconta la ricerca al NICO
Vivere per sempre.
Una popolazione sempre più longeva, i suoi problemi e le risposte della ricerca
Hai perso la diretta? Guarda ora il video di GiovedìScienza al NICO: una puntata in diretta dai nostri laboratori dedicata alla ricerca sull'invecchiamento.