Aging and Disease, giugno 2024
Ferro e mitocondri: nuovi target contro la malattia di Alzheimer
La malattia di Alzheimer (MA) è la patologia neurodegenerativa più diffusa che - come sappiamo - a causa della progressiva perdita di memoria, impedisce ai soggetti colpiti di svolgere una vita normale e indipendente. La MA colpisce il cervello dei pazienti 20-30 anni prima della manifestazione clinica, in media intorno ai 60-65 anni d’età, e rappresenta un enorme carico economico e umano per le famiglie e la società.
Sebbene la patogenesi non sia ancora del tutto chiarita, diversi studi hanno evidenziato la presenza di accumuli di ferro nel cervello di pazienti affetti da MA.
Il ferro ha un ruolo cruciale nei diversi processi fisiologici nell’organismo: l’alterazione del suo metabolismo e il suo accumulo incontrollato risulta quindi estremamente tossico e dannoso per i neuroni. Infatti, è stato dimostrato che l’accumulo cerebrale di ferro può innescare l’aumento dello stress ossidativo e morte cellulare.
Le dott.sse Serena Stanga e Mariarosa Mezzanotte (nella foto qui in alto) - ricercatrici del gruppo NICO di Sviluppo e patologia del cervello guidato dal prof. Vercelli - hanno approfondito il ruolo del ferro cerebrale e mitocondriale nella patogenesi della malattia di Alzheimer in una review pubblicata sulla rivista americana Aging and Disease.
Questi studi sono svolti nell’ambito del progetto Braccio di ferro con la demenza: ferro e mitocondri come nuovi target contro la Malattia di Alzheimer finanziato da Fondazione CRT.
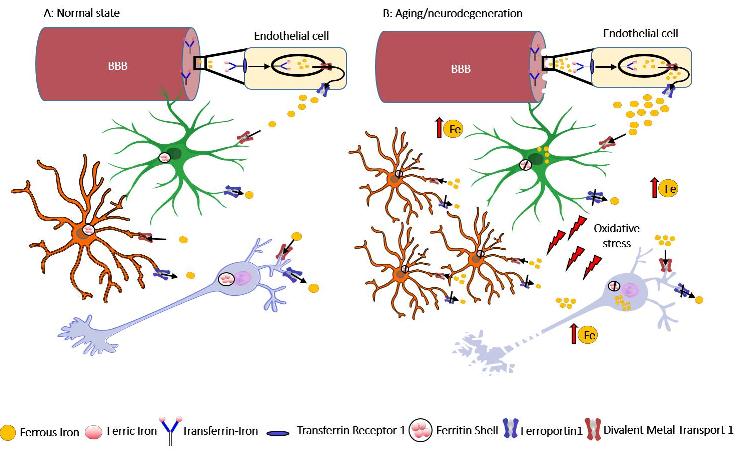
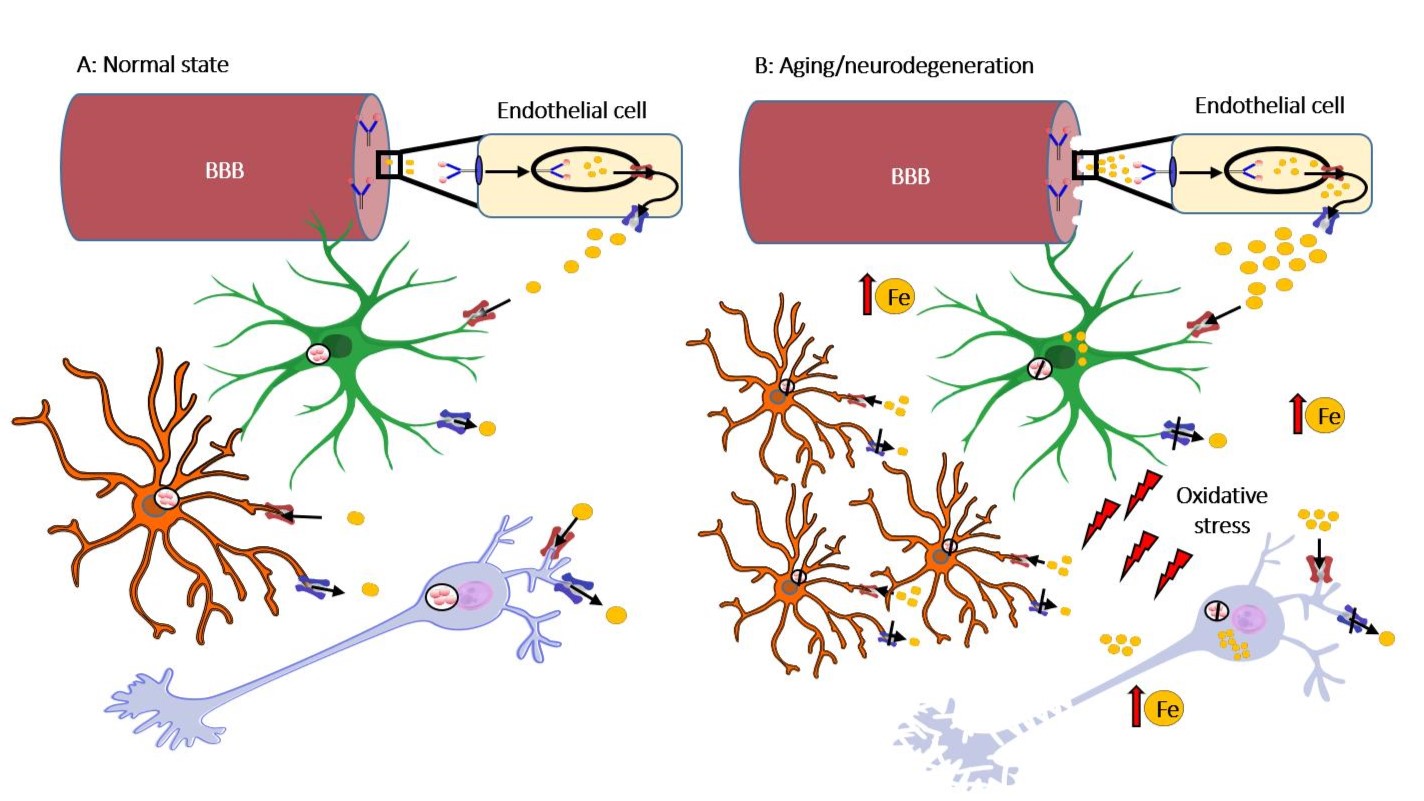
Figura 1: Omeostasi e disomeostasi del ferro. (A) Stato normale: il ferro circolante può attraversare la barriera cerebrale (BEE) legandosi alla transferrina e attraverso il meccanismo dell'endocitosi viene assorbito dalle cellule endoteliali. Una volta nel cervello, il ferro viene assorbito e si sposta continuamente tra astrociti, neuroni, oligodendrociti e microglia.
(B) Invecchiamento e neurodegenerazione: la progressiva perdita di integrità della BEE può indurre un aumento dell'ingresso di ferro con una conseguente alterazione del suo metabolismo ed accumulo nel cervello. Ciò è accompagnato da attivazione della microglia, astrogliosi e degenerazione dei neuroni.
Di recente è stata descritta una forma di morte cellulare dipendente dall’accumulo di ferro nota con il termine di ferroptosi (parola greca “ptosis” che significa “caduta” e da “ferrum” che significa ferro). Degno di nota è anche il coinvolgimento del ferro a livello mitocondriale, dove gioca un ruolo importante come cofattore per l’attività di molti enzimi che lavorano nella catena di produzione dell’energia.
In questo lavoro (Brain Iron Dyshomeostasis and Ferroptosis in Alzheimer’s Disease Pathophysiology: Two Faces of the Same Coin) le nostre ricercatrici hanno anche discusso il potenziale ruolo della ferroptosi come nuovo meccanismo patologico alla base della demenza. Infine, hanno esaminato le recenti strategie terapeutiche che indicano il metabolismo del ferro come target per approcci innovativi e di drugrepositioning potenzialmente promettenti per il trattamento dell’Alzheimer.
Figura 2: Deregolazione del ferro mitocondriale nella malattia di Alzheimer. (A) Stato normale: fisiologicamente, la proteina precursore dell'amiloide (APP) può stabilizzare la ferroportina-1 (Fpn1) per promuovere l'esporto del ferro e la proteina Tau supporta il trasporto dell'APP sulla superficie cellulare. Aβ viene prodotto in forma solubile durante il normale metabolismo cellulare. (B) Nella MA: Tau è iperfosforilata, APP è clivata e vi è una maggiore produzione di Aβ, con una conseguente alterazione dell'efflusso di ferro attraverso Fpn1, generando accumulo di ferro nelle cellule. Inoltre, il legame del ferro all’Aβ ne accelera l’aggregazione, portando ad un’alterazione della permeabilità della membrana mitocondriale e alla produzione di specie reattive dell’ossigeno (ROS) all’interno dei mitocondri e all’accumulo di ferro nella ferritina mitocondriale. In relazione a ciò, la sovrapproduzione di Aβ danneggia i mitocondri causando la disfunzione dell’attività dei complessi mitocondriali, portando alla produzione di ROS e all’esaurimento dell’adenosina trifosfato (ATP). La sovrapproduzione di ROS induce anche danni alla membrana dovuti alla perossidazione lipidica e innesca la morte cellulare.
Agenda
Area Ricercatori
Guarda il video
GiovedìScienza racconta la ricerca al NICO
Vivere per sempre.
Una popolazione sempre più longeva, i suoi problemi e le risposte della ricerca
Hai perso la diretta? Guarda ora il video di GiovedìScienza al NICO: una puntata in diretta dai nostri laboratori dedicata alla ricerca sull'invecchiamento.