Stem Cell Reports, ottobre 2024
L'inaspettato potenziale staminale del cervello adulto
Marco Fogli1, Giulia Nato2, Philip Greulich3, Jacopo Pinto4, Marta Ribodino2, Gregorio Valsania1, Paolo Peretto1, Annalisa Buffo2, Federico Luzzati5
La presenza di cellule staminali neurali adulte capaci di produrre nuovi neuroni è stata dimostrata negli anni ’90, ma sembrava limitata ad alcune zone specifiche del cervello. Studi successivi - realizzati in contemporanea al NICO e al Karolinska Institute - hanno indicato invece che anche popolazioni di astrociti all’esterno di queste nicchie possono contribuire alla neurogenesi a seguito di una lesione.
Restava tuttavia da chiarire quanti avessero questo potenziale e come potessero esprimerlo in un ambiente considerato non permissivo. Un mistero oggi meno fitto, grazie ai risultati dello studio pubblicati su Stem Cell Reports dai nostri ricercatori dei gruppi di Neurogenesi adulta e Fisiopatologia delle cellule staminali cerebrali.
La glia radiale e la magia di rigenerare parti del cervello
Nel cervello dei pesci e nelle larve di anfibi ci sono delle cellule staminali, chiamate glia radiale, capaci di rigenerare parti intere del cervello dopo una lesione: una cosa impensabile per noi mammiferi, incapaci di tanta magia. Queste cellule hanno il corpo cellulare sul ventricolo, una cavità piena di liquido posta al centro del cervello, e dei lunghi processi che raggiungono la superficie, un po’ come i pali di una palizzata.
Nei mammiferi le cellule della glia radiale esistono solo durante la vita embrionale, dove funzionano da cellule staminali producendo l’infinita varietà di tipi di neuroni che popola il nostro cervello. Al termine di questa grande fatica però le cellule della glia radiale si trasformano in astrociti, cellule di supporto dei neuroni: anche loro tappezzano l’intero cervello, ma più come delle palline da imballaggio che come una palizzata.
Con una certa sorpresa, e grandi speranze, negli anni ’90 vennero isolate dal cervello dei topi adulti due piccole sottopopolazioni di astrociti in grado di produrre neuroni e, almeno in coltura, di automantenersi: le caratteristiche delle cellule staminali. Questi astrociti si nascondevano in due piccole nicchie separate dal resto del cervello: cellule speciali necessitano di ambienti speciali, si pensava, d’altronde quasi tutte le staminali che si conoscono abitano in delle nicchie.
In realtà, in un lavoro precedente**, e in parallelo a un gruppo di ricerca del Karolinska Institute*, qui al NICO avevamo scoperto che nei topi - in seguito a una lesione - anche gli astrociti del parenchima (cioè al di fuori delle nicchie) possono mostrare un potenziale staminale latente e produrre neuroni.
*Contents | Science 386, 6724 Magnusson et al. 2014
**Striatal astrocytes produce neuroblasts in an excitotoxic model of Huntington's disease | Development | The Company of Biologists Nato et al. 2014
Il potenziale staminale degli astrociti: un mistero da chiarire
Restava tuttavia un mistero capire quanti astrociti avessero questo potenziale e come queste cellule potessero mantenere ed esprimere il loro potenziale fuori dalle nicchie. Un mistero oggi meno fitto, grazie ai risultati dello studio pubblicati di recente su Stem Cell Reports dai nostri ricercatori dei gruppi di Neurogenesi adulta - guidato dai proff. Paolo Peretto e Luca Bonfanti - e Fisiopatologia delle cellule staminali cerebrali, guidato dalla prof.ssa Annalisa Buffo.
In questo nuovo lavoro, condotto nel topo, il prof. Federico Luzzati con la dr.ssa Giulia Nato e il dr. Marco Fogli hanno ricostruito nel tempo e nello spazio la produzione neurogenica di singoli astrociti in un modello di lesione dello striato, una regione del cervello coinvolta nel controllo del movimento e in diverse patologie come l’Huntington o il Parkinson.
Magic team NICO, da sinistra: Marta Ribodino e Annalisa Buffo (responsabile del gruppo di ricerca di Fisiopatologia delle cellule staminali neurali), Giulia Nato, Federico Luzzati e Marco Fogli, del gruppo di Neurogenesi adulta.
«Non è stato semplice spiare la vita privata di tutti gli astrociti in una regione relativamente grossa e posta in profondità nel cervello, ma ci siamo riusciti – commenta Federico Luzzati - Abbiamo così scoperto che gli astrociti del parenchima si comportano come quelli delle nicchie: in modo apparentemente casuale alcuni astrociti si accendono e ognuno dà vita a un gruppetto di cellule altamente proliferanti che per circa 10 giorni produce continuamente neuroni».
Dopo aver figliato, l’astrocita si riaddormenta mentre - di lì a poco - se ne sveglia un altro, garantendo così una produzione di nuovi neuroni continua e ben distribuita. Il dato sorprendente è che il tasso di attivazione nello striato è lo stesso misurato nelle nicchie canoniche: ciò suggerisce che il potenziale neurogenico del parenchima maturo del cervello, almeno nello striato, sia equivalente a quello delle nicchie canoniche e potrebbe coinvolgere tutti gli astrociti.
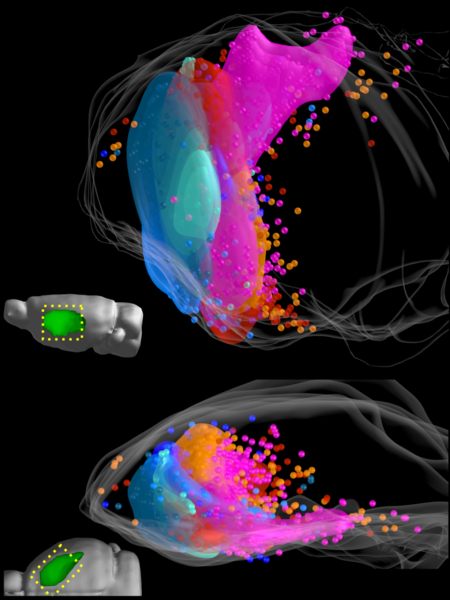
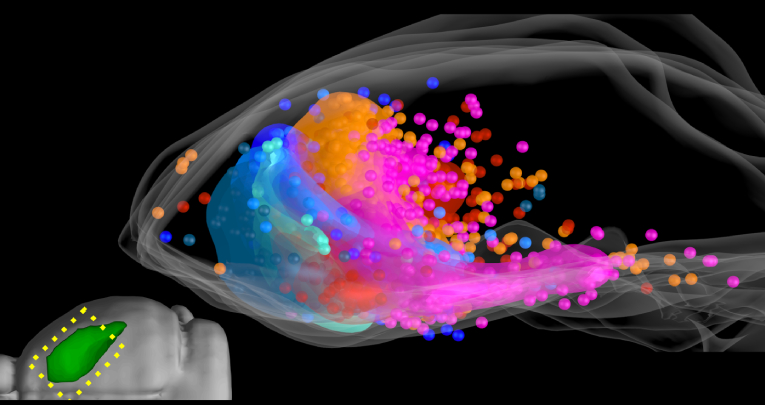
3D Clusters distribution 7 specimens lateral view
Visione dorsale e/o laterale della distribuzione dei foci neurogenici, sia come palline che come nuvola complessiva, di 7 animali sovrapposti, colorati per animale. Ognuno di questi foci rappresenta la posizione di un astrocita che si è attivato nei 10 giorni precedenti.
Questa immagine mostra che il potenziale neurogenico è largamente diffuso nello striato
«Improvvisamente il cervello di staminali sembra averne pure troppe! Ma allora perché non rigenera? Il problema - spiega il prof. Luzzati - è che i neuroni sono tanti, tutti diversi e, in base a uno studio che stiamo completando, il potenziale che risvegliamo non sembra essere ampio abbastanza. Per rigenerare il nostro cervello servirà sicuramente intervenire artificialmente, ma almeno ora sappiamo che la materia prima non manca!».
Allo stesso tempo, questo potenziale latente potrebbe rappresentare un rischio per lo sviluppo di tumori che potrebbero sfruttare meccanismi fisiologici per espandersi nel parenchima. Questo potenziale inatteso e misterioso apre interessanti prospettive, ma restano però ancora molti segreti da svelare. «Il primo della nostra lista – conclude Luzzati - è capire che tipo di neuroni vengono prodotti: di questo speriamo di potervi raccontare nel prossimo futuro».
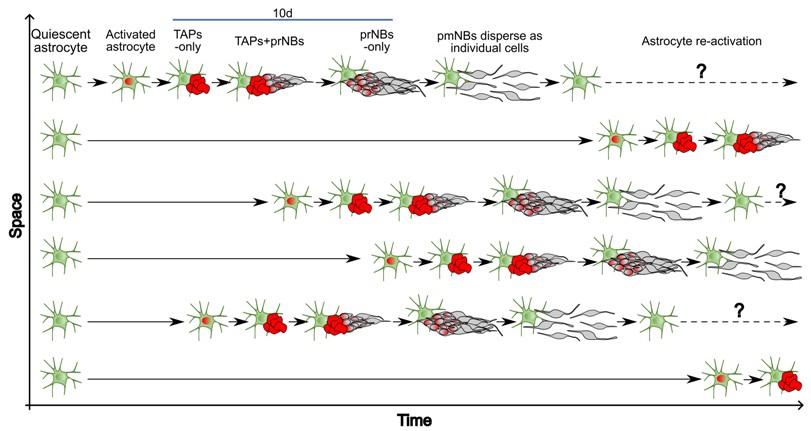
Il pattern spazio-temporale che caratterizza l’attività neurogenica degli astrociti striatali assomiglia molto quelle delle classiche nicchie staminali del cervello dei vertebrati adulti. Gli eventi di attivazione degli astrociti striatali sono costanti nel tempo (asse X), avvengono ad un tasso simile a quello degli astrociti della Zona Sottoventricolare, e sono casuali nello spazio (asse Y), risultando in una stadio stazionario di neurogenesi continua e diffusa. Quando si attivano, gli astrociti striatali generano un clone di progenitori intermedi (TAPs) che si espandono e differenziano in neuroblasti (NBs), che inizialmente proliferano (prNBs) prima di diventare post-mitotici (pmNBs). Ogni clone si espande e matura indipendentemente dagli altri nel giro di circa 10 giorni ed, infine, tutti i pmNBs si disperdono nello striato. In modo interessante, gli astrociti striatali ritornano in quiescenza dopo la loro attivazione, permettendo il mantenimento della popolazione astrocitaria.
Stem Cell Reports, 2024 Oct 8
Dynamic spatiotemporal activation of a pervasive neurogenic competence in striatal astrocytes supports continuous neurogenesis following injury
Marco Fogli1, Giulia Nato2, Philip Greulich3, Jacopo Pinto4, Marta Ribodino2, Gregorio Valsania1, Paolo Peretto1, Annalisa Buffo2, Federico Luzzati5
1 Neuroscience Institute Cavalieri Ottolenghi, Orbassano (Turin), Italy; Department of Life Sciences and System Biology, University of Turin, Turin, Italy.
2 Neuroscience Institute Cavalieri Ottolenghi, Orbassano (Turin), Italy; Department of Neurosciences "Rita Levi Montalcini", University of Turin, Turin, Italy.
3 School of Mathematical Sciences, University of Southampton, Southampton, UK; Institute for Life Sciences (IfLS), University of Southampton, Southampton, UK.
4 Department of Life Sciences and System Biology, University of Turin, Turin, Italy.
5 Neuroscience Institute Cavalieri Ottolenghi, Orbassano (Turin), Italy; Department of Life Sciences and System Biology, University of Turin, Turin, Italy. Electronic address: federico.luzzati@unito.it.
Agenda
Area Ricercatori
Guarda il video
GiovedìScienza racconta la ricerca al NICO
Vivere per sempre.
Una popolazione sempre più longeva, i suoi problemi e le risposte della ricerca
Hai perso la diretta? Guarda ora il video di GiovedìScienza al NICO: una puntata in diretta dai nostri laboratori dedicata alla ricerca sull'invecchiamento.