Aging Cell, ottobre 2016
Malattia di Alzheimer: uno studio sui monomeri Aβ1-42
Manassero G1,2,3, Guglielmotto M1,2, Zamfir R2, Borghi R3, Colombo L4, Salmona M4, Perry G5, Odetti P3,6, Arancio O7, Tamagno E1,2, Tabaton M3
Numerosi dati di letteratura indicano che nella malattia di Alzheimer (AD) l'accumulo di amiloide β (Aβ) nel cervello rappresenta l'evento primario e precoce che induce degenerazione neuronale, caratterizzata poi da accumulo di proteina Tau alterata e aggregata.
Aβ deriva da due tagli endoproteolitici successivi operati su una proteina precursore (APP). Il primo taglio viene eseguito dalla β secretasi (BACE1) che produce un frammento N-terminale ancorato alla membrana su cui agirà in successione la γ-secretasi, per generare frammenti di lunghezza variabile, soprattutto Aβ 40 e 42. Aβ1-42 aggrega più rapidamente rispetto all’Aβ1-40. La polimerizzazione Aβ1-42 si crede che avvenga in fasi sequenziali: prima i monomeri aggregano in oligomeri solubili che poi formano oligomeri insolubili, protofibrille e fibrille.
In questo lavoro abbiamo dimostrato che i monomeri di Aβ1-42, inoculati intraventricolarmente nel cervello di topi transgenici esprimenti la proteina Tau umana (hTau) inducono un cambiamento conformazionale patologico della proteina Tau mediato dalla sua iperfosforilazione e dall’aumento dei suoi livelli totali, attraverso un'inibizione dei meccanismi che la degradano.
Questi risultati suggeriscono che i monomeri di Aβ1-42 in eccesso inducono Taupatia e che quindi le terapie anti Aβ1-42 devono essere indirizzate anche all’eliminazione dei monomeri e non soltanto degli oligomeri, da sempre considerati le forme maggiormente tossiche.
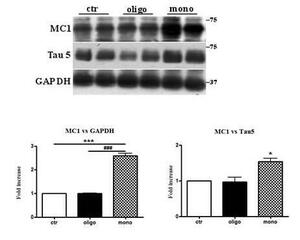
I monomeri di Aβ1-42 inducono un cambio conformazionale della proteina Tau.
Western blot rappresentativo di estratti di tessuto cerebrale da topi hTau di 2 mesi di controllo (salina) e trattati ICV (Aβ1-42peptide) per 3 ore rivelato con un anticorpo conformazionale anti Tau (MC1) e un anticorpo diretto verso la proteina Tau totale (Tau5). Un anticorpo diretto contro GAPDH o Tau 5 è stato utilizzato per controllare il corretto caricamento dei campioni. L’analisi densitometrica mostra un significativo aumento rivelato con Mc1 e Tau 5 mediato dai monomeri. I dati rappresentano la media + SEM, *p<0.05; **p<0.01 vs controllo con one-way ANOVA e Bonferroni post hoc test, n=6.
1Department of Neuroscience, University of Torino, via Cherasco 15, 10126, Torino, Italy.
2Neuroscience Institute of Cavalieri Ottolenghi Foundation (NICO), University of Torino, Regione Gonzole 10, 10043, Orbassano, Torino, Italy.
3Unit of Geriatric Medicine, Department of Internal Medicine and Medical Specialties (DIMI), University of Genova, Viale Benedetto XV, 6, 16132, Genova, Italy.
4Department of Molecular Biochemistry and Pharmacology, IRCCS-Istituto di Ricerche Farmacologiche 'Mario Negri', Via Giuseppe La Masa, 19, 20156, Milan, Italy.
5College of Sciences, The University of Texas at San Antonio, One UTSA Circle, San Antonio, TX, 78249, USA.
6IRCCS San Martino-IST, University of Genova, Viale Benedetto XV, 6, 16132, Genova, Italy.
7Department of Pathology and Cell Biology, Taub Institute for Research on Alzheimer's Disease and the Aging Brain, Columbia University, 630 West 168th Street, P&S 12-420D, New York, NY, 10032, USA.
Agenda
Area Ricercatori
Guarda il video
GiovedìScienza racconta la ricerca al NICO
Vivere per sempre.
Una popolazione sempre più longeva, i suoi problemi e le risposte della ricerca
Hai perso la diretta? Guarda ora il video di GiovedìScienza al NICO: una puntata in diretta dai nostri laboratori dedicata alla ricerca sull'invecchiamento.