Acta Neuropathologica, luglio 2019
Sclerosi multipla: chiarito il meccanismo che ‘infiamma’ gli astrociti nelle lesioni della mielina
Lo studio coordinato dall’Istituto di neuroscienze del Cnr di Milano dimostra che la microglia - cellule immunitarie del sistema nervoso - sarebbe di per sé sempre benefica sui precursori degli oligodendrociti, le cellule in grado di riparare le lesioni mieliniche, ma può diventare dannosa quando attiva un altro tipo di cellule presenti nel cervello, gli astrociti.
Marta Lombardi1,2, Roberta Parolisi3, Federica Scaroni2, Elisabetta Bonfanti4, Alice Gualerzi5, Martina Gabrielli2, Nicole Kerlero de Rosbo6, Antonio Uccelli6,7, Paola Giussani8, Paola Viani8, Cecilia Garlanda9, Maria P. Abbracchio4, Linda Chaabane10, Annalisa Buffo3, Marta Fumagalli4, Claudia Verderio2.
La sclerosi multipla è una malattia neurologica progressiva caratterizzata da infiammazione cronica del tessuto cerebrale e da lesioni alla guaina mielinica che avvolge i prolungamenti nervosi garantendone l’integrità e consentendo la trasmissione veloce dei segnali. La microglia, le cellule immunitarie del sistema nervoso, contribuiscono a questo danno e alle successive fasi, esercitando un effetto diretto sugli oligodendrociti (le cellule responsabili della produzione di mielina) e sui loro precursori (OPCs, cellule precursori degli oligodendrociti). Tuttavia, le modalità di azione della microglia nel facilitare o inibire la riparazione della mielina sono ancora poco chiare.
Il lavoro recentemente pubblicato sulla prestigiosa rivista Acta Neuropathologica, frutto di una collaborazione con diversi Istituti di ricerca tra cui il laboratorio della Dr.ssa Claudia Verderio dell’Istituto di Neuroscienze del Consiglio Nazionale delle Ricerche (CNR-IN) di Milano (coordinatrice del progetto), l’Università degli Studi di Milano (gruppi della prof.ssa Abbracchio e prof.ssa Viani), il laboratorio di Fisiopatologia delle cellule staminali cerebrali del NICO - Università di Torino, guidato dalla prof.ssa Annalisa Buffo, e l’Università e il Policlinico San Martino di Genova (gruppo del Prof. Antonio Uccelli), ha valutato l’effetto delle vescicole extracellulari (EV) prodotte in vitro da microglia pro-infiammatoria o pro-rigenerativa sugli OPCs, in esperimenti in vitro e nel modello murino di demielinizzazione focale con lisolecitina.
Lo studio è stato finanziato principalmente dal grant Multiple Sclerosis Innovation di MerK Serono e dalla Fondazione Italiana Sclerosi Multipla.
I primi esperimenti hanno mostrato che gli effetti della microglia sono mediati dalla liberazione di vescicole extracellulari (EV) che in vitro hanno sempre un effetto benefico sugli oligodendrociti, indipendentemente dallo stimolo che ha causato l’attivazione microgliale. Gli esperimenti in vivo - interamente svolti al NICO da Roberta Parolisi, postdoc presso il laboratorio della prof.ssa Buffo - e la loro analisi mediante imaging confocale e microscopia elettronica, hanno dimostrato che le EV rilasciate dalla microglia pro-infiammatoria bloccano il processo riparativo, mentre le EV prodotte dalla microglia pre-esposta a cellule mesenchimali (cellule immunomodulanti) promuovono il reclutamento di OPC e la riparazione della mielina. Questi risultati hanno suggerito il coinvolgimento in vivo di altri tipi di cellule presenti nel tessuto nervoso.
A questo punto l’esperimento in vitro è stato ripetuto, aggiungendo alla cultura di oligodendrociti le EV ottenute da microglia infiammata in presenza di astrociti. I risultati hanno dimostrato che gli astrociti “condizionati” dalle vescicole infiammate, contenenti la nota citochina TNFα, acquisiscono un fenotipo dannoso, che è il vero responsabile del blocco mielinico. Questo secondo gruppo di esperimenti ha anche evidenziato che l’effetto benefico delle cellule mesenchimali è mediato dai lipidi presenti nella membrana delle vescicole in grado di favorire sia la migrazione degli oligodendrociti verso il sito del danno che la loro maturazione a cellule mielinizzanti.
Questo studio evidenzia l’azione delle EV sia sugli OPC che sugli astrociti coinvolti nelle lesioni della mielina, indicando il loro possibile contributo nello sviluppo di nuovi approcci terapeutici per la riparazione della mielina nelle malattie neurologiche e neuropsichiatriche caratterizzate da demielinizzazione.
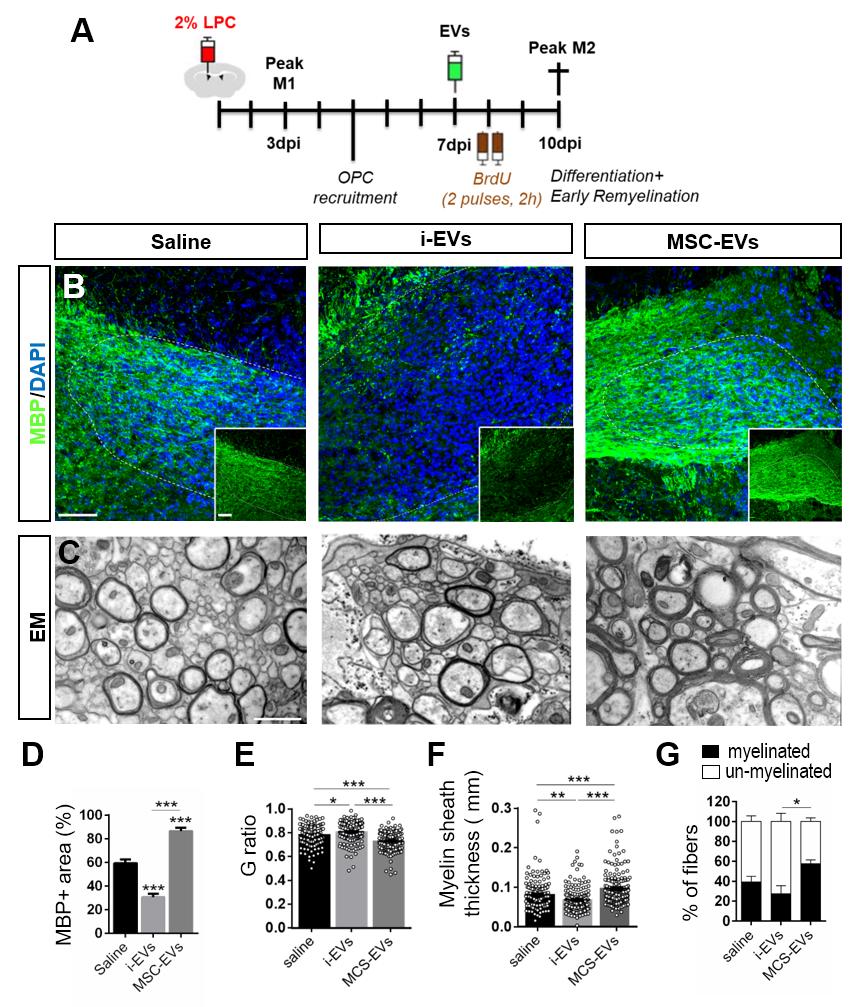
Effetto delle vescicole extracellulari (EVs) nel processo di ri-mielinizzazione nel modello murino di lesione focale indotto da lisolecitina.
A, Protocollo sperimentale: l'iniezione focale di lisolecitina nel corpo calloso di topi (8-12 mesi di età) causa demielinizzazione nell’area dell’inoculazione. Le EVs sono state somministrate con una singola iniezione nel sito di lesione a 7 giorni dall’iniezione di lisolecitina (fase di cui i precursori degli oligodendrociti (OPCs) iniziano il loro differenziamento in oligodendrociti maturi). Il processo di ri-mielinizzazione è analizzato10 giorni dopo la lesione.
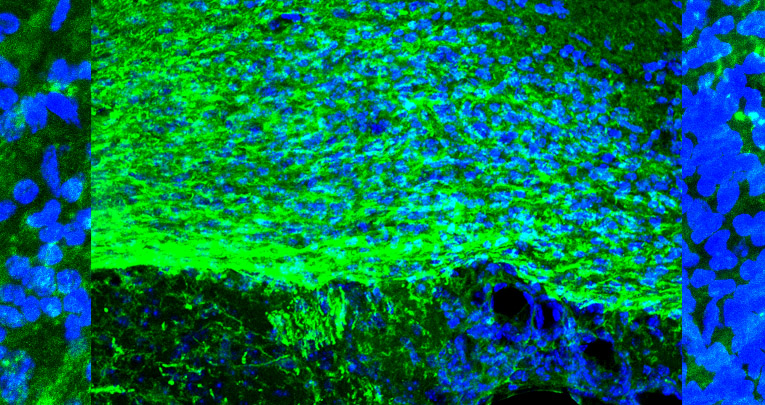
B, Immagini rappresentative della mielina (positiva per MBP (verde)) in lesione dopo la somministrazione di EV infiammatorie (i-EVs) o EV infiammatorie pretrattate con cellule mesenchimali (MSC-EVs). La salina è stata utilizzata come controllo (Saline). (L’area lesionata è delimitata dalla linea tratteggiata) (Barra di calibrazione, 50 μm).
C,Immagini rappresentative dell’ultrastruttura della lesione dopo somministrazione di i-EVs, MSCs-EVso salina. (Barra di calibrazione, 1 μm).
D, Il grafico indica la percentuale di area MBP+ nella lesione dopo somministrazione di i-EVs, MSCs-EVso salina(N=3-4 topi per gruppo; One Way ANOVA p<0,0001 with Holm-Sidak's multiple comparisons test).
E-G,I grafici mostrano la percentuale di fibre amieliniche/mieliniche(N=3-4 topi per gruppo; One Way ANOVA p=0.039 with Dunn's multiple comparison test) (E), la quantificazione del G-ratio (N=3 topi per gruppo; Kruskal-Wallis test p< 0,0001 with Dunn's multiple comparisons test) (F) e la quantificazione dello spessore della mielina (N=3 topi per gruppo; Kruskal-Wallis test p< 0,0001 with Dunn's multiple comparisons test) (G) dopo la somministrazione di i-EVs, MSCs-EVso salina.
1 IRCCS Humanitas, Rozzano, Italy
2 CNR Institute of Neuroscience, Milan, Italy
3 Department of Neuroscience Rita Levi‑Montalcini and Neuroscience Institute Cavalieri Ottolenghi, University of Turin, Orbassano, Italy
4 Department of Excellence: Department of Pharmacological and Biomolecular Sciences (DiSFeB), University of Milan, Milan, Italy
5 IRCCS Fondazione Don Carlo Gnocchi, Milan, Italy
6 Department of Neurology, Rehabilitation, Ophthalmology, Genetics, Maternal and Child Health (DINOGMI), University of Genoa, Genoa, Italy
7 IRCCS Ospedale Policlinico San Martino, Genoa, Italy
8 Department of Biotechnology and Translational Medicine, University of Milan, Segrate, Italy
9 Humanitas University, Rozzano, Italy
10 Institute of Experimental Neurology (INSPE), San Raffaele Scientific Institute, Milan, Italy
Agenda
Area Ricercatori
Guarda il video
GiovedìScienza racconta la ricerca al NICO
Vivere per sempre.
Una popolazione sempre più longeva, i suoi problemi e le risposte della ricerca
Hai perso la diretta? Guarda ora il video di GiovedìScienza al NICO: una puntata in diretta dai nostri laboratori dedicata alla ricerca sull'invecchiamento.