Su Brain lo studio guidato dall’Università di Torino
Interferenza a RNA: un approccio terapeutico innovativo per la leucodistrofia, una rara malattia neurodegenerativa
Dimostrata per la prima volta l’efficacia dell’iRNA su neuroni differenziati a partire da cellule staminali di pazienti. Lo studio, guidato da Alfredo Brusco e dalla nostra ricercatrice Annalisa Buffo, propone una nuova strategia terapeutica per curare malattie genetiche associate alla duplicazione di un gene, come la leucodistrofia autosomica dominante ad esordio in età adulta (ADLD).
Giorgio E1, Lorenzati M2, Rivetti di Val Cervo P3, Brussino A1, Cernigoj M3, Della Sala E1, Bartoletti Stella A4, Ferrero M1, Caiazzo M5,6, Capellari S4,7, Cortelli P4,7, Conti L8, Cattaneo E3,9, Buffo A2, Brusco A1,10.
Il gruppo di ricerca di UNITO
da sinistra: Alfredo Brusco, Alessandro Brussino, Elisa Giorgio, Annalisa Buffo (al centro), Martina Lorenzati e Marta Ferrero
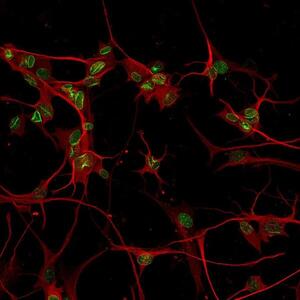
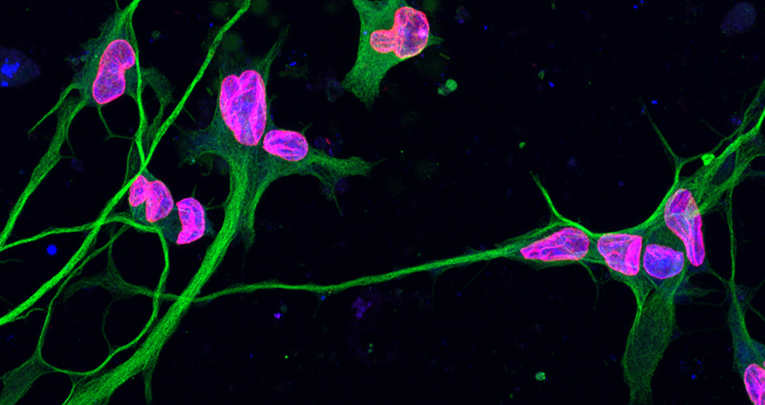
Immagine in alto - Neuroni differenziati a partire da fibroblasti (cellule del derma) di pazienti malati di leucodostrofia. In fucsia si può apprezzare la lamina B1 con la sua classica localizzazione perinucleare (da notare le invaginazioni caratteristiche della patologia), in verde la tubulina (marcatore neuronale) e in blu il DAPI (colorazione nucleare).
L’interferenza a RNA (iRNA) è un meccanismo fisiologico presente in tutte le nostre cellule, neuronali e non, che sfrutta piccole molecole di RNA a doppio filamento per regolare l’espressione genica e proteggerci dagli agenti patogeni.
In particolare, l’appaiamento tra una molecola di RNA messaggero (a singolo filamento, trascritto a partire dal DNA) e un’altra molecola di RNA complementare (RNA interferente) porta alla formazione di una molecola di RNA a doppio filamento, che non può fisicamente essere tradotta in proteina, e viene quindi portata a degradazione.
Neuroni differenziati a partire da fibroblasti (cellule del derma) di pazienti malati di leucodostrofia. In verde si può apprezzare la lamina B1 con la sua classica localizzazione perinucleare (da notare le invaginazioni caratteristiche della patologia), e in rosso la tubulina (marcatore neuronale).
Oggi per la prima volta l’iRNA viene proposto come strategia terapeutica per curare malattie genetiche associate alla duplicazione di un gene, ovvero alla presenza di tre copie di un gene, anziché le due fisiologiche (a cui corrisponde una conseguente sovrapproduzione di proteina) e in cui spegnere in maniera specifica la copia “in eccesso” può rappresentare una cura.
È il risultato di uno studio pubblicato sulla prestigiosa rivista “Brain” dal gruppo del prof. Alfredo Brusco (Università di Torino, Dipartimento di Scienze Mediche) in collaborazione con i laboratori delle prof.sse Annalisa Buffo (Dipartimento di Neuroscienze Rita-Levi Montalcini - UNITO) - che qui al NICO guida il gruppo di Fisiopatologia delle cellule staminali cerebrali - ed Elena Cattaneo (Università di Milano), e del prof. Pietro Cortelli (IRCCS, Istituto delle Scienze Neurologiche di Bologna e Università di Bologna).
Sfruttando l’iRNA i ricercatori sono riusciti a riportare a livelli fisiologici i livelli della proteina lamina B1 (LMNB1), la cui presenza eccessiva nel sistema nervoso è causa di una rara patologia, la leucodistrofia autosomica dominante ad esordio in età adulta (ADLD).
In questa malattia l’eccessivo accumulo di LMNB1 è dovuto ad una duplicazione del gene che ne contiene le istruzioni. LMNB1 prodotta in eccesso determina la degenerazione dei tratti di connessione dei neuroni, la cosiddetta “sostanza bianca” del sistema nervoso centrale, disturbi del movimento e gravi alterazioni del sistema nervoso autonomo.
L’ADLD è estremamente rara, tanto che sono note solo poche decine famiglie in tutto il mondo; si trasmette da genitore affetto ai figli con la probabilità del 50%, ed è al momento incurabile.
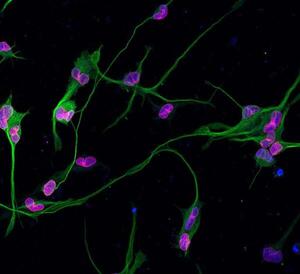
Immagine a destra - Neuroni differenziati a partire da fibroblasti (cellule del derma) di consanguinei sani di pazienti malati di leucodostrofia. In fucsia si può apprezzare la lamina B1 con la sua classica localizzazione perinucleare, in verde la tubulina (marcatore neuronale) e in blu il DAPI (colorazione nucleare).
La ricerca, condotta dalla Dott.ssa Elisa Giorgio (Dipartimento di Scienze Mediche dell’Università di Torino) anche grazie al finanziamento di Fondazione Umberto Veronesi, ha dimostrato che l’iRNA può essere sfruttata per spegnere selettivamente una delle tre copie del gene LMNB1, quella in eccesso (iRNA allele-specifica), e riportare così i livelli di lamina B1 alla normalità, evitando l’accumulo della proteina e la malattia.
È importante notare che la strategia allele-specifica sviluppata non causa il completo spegnimento del gene bersaglio, il che potrebbe risultare molto dannoso per le cellule e provocare una patologia più grave di quella che si vuole curare. L’interferenza a RNA allele-specifica permette invece di mantenere trascrizionalmente attive le due copie fisiologiche del gene bersaglio. Si tratta quindi di un approccio molto sicuro.
Per dimostrare l’efficacia dell’approccio, la Dott.ssa Giorgio e la Dott.ssa Martina Lorenzati (ricercatrice del gruppo NICO di Sviluppo e patologia del cervello, guidato da Alessandro Vercelli) si sono avvalse di modelli cellulari innovativi, quali cellule neuronali generate a partire da fibroblasti (cellule del derma) dei pazienti ADLD, un metodo anche noto come “malattia in piastra”, e cellule nervose di roditore (oligodendrociti) alle quali è stata aggiunta una copia in più del gene umano LMNB1. Si è così riusciti a testare l’efficacia del trattamento non solo su più tipi cellulari, ma anche a cellule simili a quelle colpite nel cervello dei pazienti.
Il silenziamento per interferenza allele-specifico apre nuove prospettive di ricerca nel campo di malattie genetiche legate ad un eccesso di dose (duplicazioni geniche), anche se il passaggio a vere terapie per i pazienti potrà avvenire solo attraverso sviluppi specifici.
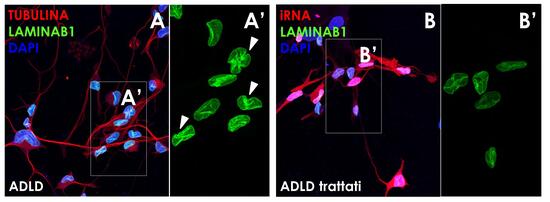
Pannello 1. La strategia dell’interferenza a RNA in neuroni differenziati da fibroblasti.
Nella figura A si possono apprezzare neuroni differenziati a partire da fibroblasti di pazienti (ADLD), in cui la lamina B1 è presente in maggiore quantità (A’) e porta a caratteristiche invaginazioni, indicative di patologia (A’, indicate con le frecce). Il trattamento con l’iRNA (figure B-B’) ha riportato la lamina B1 ai livelli fisiologici, recuperando anche il corretto fenotipo nucleare (B’). In rosso la tubulina (marker neuronale, fig. A) e l’iRNA (fig. B), in verde la lamina B1 e in blu il DAPI (colorazione nucleare).
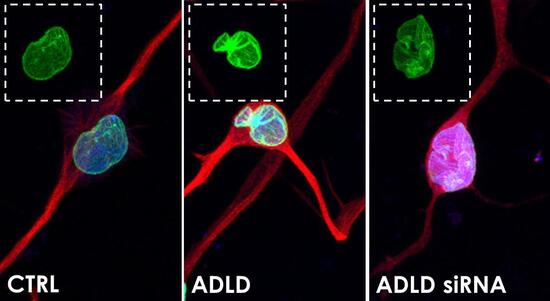
Pannello 2. La strategia dell’interferenza a RNA in neuroni differenziati da fibroblasti.
Nella figura si possono apprezzare neuroni differenziati a partire da fibroblasti di controlli sani e di pazienti (CTRL e ADLD). Negli ADLD la lamina B1 è presente in maggiore quantità rispetto ai CTRL, e porta a caratteristiche invaginazioni, indicative di patologia. Il trattamento con l’iRNA (ADLD siRNA) ha riportato la lamina B1 ai livelli fisiologici, recuperando anche il corretto fenotipo nucleare. In rosso la tubulina (marker neuronale, CTRL e ADLD) e l’iRNA (ADLD siRNA), in verde la lamina B1 e in blu il DAPI (colorazione nucleare).
Brain, 29 maggio 2019
Allele-specific silencing as treatment for gene duplication disorders: proof-of-principle in autosomal dominant leukodystrophy.
Giorgio E1, Lorenzati M2, Rivetti di Val Cervo P3, Brussino A1, Cernigoj M3, Della Sala E1, Bartoletti Stella A4, Ferrero M1, Caiazzo M5,6, Capellari S4,7, Cortelli P4,7, Conti L8, Cattaneo E3,9, Buffo A2, Brusco A1,10.
1 University of Torino, Department of Medical Sciences, 10126, Torino, Italy.
2 University of Torino, Department of Neuroscience Rita Levi Montalcini and NeuroscienceInstitute Cavalieri Ottolenghi (NICO), Orbassano, 10043, Torino, Italy.
3 University of Milan, Department of Biosciences, Laboratory of Stem Cell Biology and Pharmacology of Neurodegenerative Diseases, 20122 Milan, Italy.
4 IRCCS Istituto delle Scienze Neurologiche di Bologna, Bellaria Hospital, 40139, Bologna, Italy.
5 Department of Pharmaceutics, Utrecht Institute for Pharmaceutical Sciences (UIPS), Utrecht University, Universiteitsweg 99, 3584, CG, Utrecht, The Netherlands.
6 Department of Molecular Medicine and Medical Biotechnology, University of Naples 'Federico II', 80131, Naples, Italy.
7 University of Bologna, Department of Biomedical and Neuromotor Sciences, 40123, Bologna, Italy.
8 University of Trento, Centre for Integrative Biology (CIBIO), Laboratory of Computational Oncology, 38123, Trento, Italy.
9 National Institute of Molecular Genetics (INGM) Romeo and EnricaInvernizzi, 20122, Milano, Italy.
10 Città della Salute e della Scienza University Hospital, Medical Genetics Unit, 10126, Torino, Italy.
Agenda
Area Ricercatori
Guarda il video
GiovedìScienza racconta la ricerca al NICO
Vivere per sempre.
Una popolazione sempre più longeva, i suoi problemi e le risposte della ricerca
Hai perso la diretta? Guarda ora il video di GiovedìScienza al NICO: una puntata in diretta dai nostri laboratori dedicata alla ricerca sull'invecchiamento.