Frontiers in Endocrinology, 9 aprile 2018
La complessa influenza degli ormoni sessuali sulla neurogenesi adulta nella zona sottoventricolare
Giovanna Ponti1,2, Alice Farinetti2,3, Marilena Marraudino2,3 GianCarlo Panzica2,3, Stefano Gotti2,3
Nell’encefalo della maggior parte dei mammiferi adulti vi sono solo due aree in cui vengono generati nuovi neuroni in età adulta: la zona sottoventricolare (SVZ) e la zona sottogranulare del giro dentato dell’ippocampo. Sebbene vi siano alcune similitudini, è interessante notare come la neurogenesi sia regolata in maniera profondamente differente in queste due zone.
Tuttavia, è sorprendente che il ruolo degli ormoni sessuali nel controllo della neurogenesi adulta nell’SVZ sia poco studiato, data l’importanza di tali ormoni nella modulazione dei comportamenti sociali, riproduttivi e parentali, fortemente associati a questa area cerebrale. Questi comportamenti sono differenti in maschi e femmine, e in queste cambiano durante la vita riproduttiva, sia con il ciclo estrale che con la gravidanza. Un ruolo chiave nel controllo di questi comportamenti è proprio quello degli interneuroni del bulbo olfattivo, generati continuamente in età adulta a partire dall’SVZ (Peretto and Paredes, 2014).
Infatti, cellule staminali neurali (cellule di tipo B1) a contatto del ventricolo laterale (LV) proliferano e danno origine a progenitori intermedi (cellule di tipo C) che si moltiplicano a loro volta e generano precursori neuronali (cellule di tipo A) (Lim and Alvarez-Buylla 2018; Ponti et al., 2013). Tali cellule continuano a proliferare e migrano lungo la stria migratoria rostrale fino a raggiungere il bulbo olfattivo dove differenziano in vari tipi di interneuroni. Molti fattori endogeni ed esogeni regolano questo processo agendo a livelli differenti. In questo quadro, il ruolo degli ormoni sessuali è estremamente complesso.
In questa review, realizzata dal gruppo di Neuroendocrinologia, abbiamo cercato di integrare tra loro diversi studi per comprendere il ruolo degli ormoni sessuali in questo fenomeno. In generale, il testosterone è l’ormone steroideo che ha maggior effetto sull’SVZ dei maschi, cosa che abbiamo osservato anche in un nostro precedente studio sui ratti (Farinetti et al., 2015) mentre nelle femmine quello maggiormente attivo è l’estradiolo. Tali ormoni possono determinare un effetto differente a seconda del sesso, dell’età e del ceppo analizzato, oltre che del parametro in esame.
Maschi e femmine presentano numerose differenze. Alcune di queste sono determinate dai livelli di ormoni steroidei negli adulti, mentre altre si formano già durante lo sviluppo. Il ruolo degli ormoni steroidei nella neurogenesi adulta, come su altri comportamenti, inoltre, varia durante le varie fasi della vita riproduttiva dell’individuo. Ci sono importanti differenze specie-specifiche tra i vari modelli murini che interessano sia il comportamento sociale/materno sia l’entità della neurogenesi adulta nell’SVZ. L’entità della neurogenesi adulta dipende dal bilancio tra proliferazione, differenziamento, migrazione e morte cellulare delle diverse popolazioni cellulari del lineage neurogenetico. Ciascuno di questi fenomeni può essere modulato da vari ormoni in maniera indipendente, e secondo meccanismi che possono essere diretti o indiretti, tramite modificazioni dell’ambiente cellulare. È quindi necessario tenere conto della complessità del sistema e di tutte le variabili coinvolte per poter mettere in relazione fra loro i numerosi studi presenti in letteratura sulla neurogenesi adulta nell’SVZ.
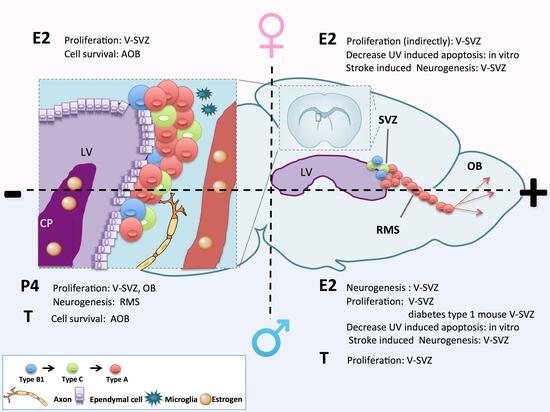
Figura - Schema che illustra il ruolo degli ormoni sessuali sulla neurogenesi adulta nel sistema SVZ-OB. La neurogenesi adulta è un fenomeno complesso che avviene in tre diverse regioni: la zona sottoventricolare (SVZ), la stria migratoria rostrale (RMS), ed il bulbo olfattivo (OB). Gli ormoni sessuali che raggiungono il ventricolo laterale (LV) tramite il plesso coroideo (CP) od I capillary sanguigni (BV) modulano ogni passo di questo processo agendo o direttamente sulle popolazioni neurogenetiche o indirettamente tramite altri component della nicchia staminale neurale o del parenchima. Il ruolo degli ormoni sessuali sulle femmine è mostrato nella parte alta della figura mentre quello sui maschi è indicato in basso. Nella parte sinistra della figura sono indicati gli ormoni che diminuiscono (-) l’entità della neurogenesi agendo su un particolare suo aspetto, mentre nella parte a destra sono indicati quelli che l’aumentano (+).
1 Department of Veterinary Sciences, University of Turin, Grugliasco (TO), Italy
2 Neuroscience Institute Cavalieri Ottolenghi (NICO), Orbassano (TO), Italy
3 Department of Neuroscience “Rita Levi-Montalcini”, University of Turin, Turin (TO), Italy
Agenda
Area Ricercatori
Guarda il video
GiovedìScienza racconta la ricerca al NICO
Vivere per sempre.
Una popolazione sempre più longeva, i suoi problemi e le risposte della ricerca
Hai perso la diretta? Guarda ora il video di GiovedìScienza al NICO: una puntata in diretta dai nostri laboratori dedicata alla ricerca sull'invecchiamento.